×
 4 Lektionen
4 Lektionen
 8 Lektionen
8 Lektionen
 4 Lektionen
4 Lektionen
 2 Lektionen
2 Lektionen
 2 Lektionen
2 Lektionen
 5 Lektionen
5 Lektionen
 4 Lektionen
4 Lektionen
 4 Lektionen
4 Lektionen
 7 Lektionen
7 Lektionen
 4 Lektionen
4 Lektionen
 6 Lektionen
6 Lektionen
 4 Lektionen
4 Lektionen
 4 Lektionen
4 Lektionen
 12 Lektionen
12 Lektionen
Wundmanager für Pflegefachkräfte
Grundlagen der Führung der Pflegedokumentation
 4 Lektionen
4 Lektionen
Pflege von Menschen mit chronischen Wunden
 8 Lektionen
8 Lektionen
Dekubitusprophylaxe in der Pflege
 4 Lektionen
4 Lektionen
Ulcus Cruris
 2 Lektionen
2 Lektionen
Diabetischer Fuß
 2 Lektionen
2 Lektionen
Wundbeurteilung und -dokumentation
 5 Lektionen
5 Lektionen
Entlassungsmanagement
 4 Lektionen
4 Lektionen
Akute Schmerzen
 4 Lektionen
4 Lektionen
Kompressionstherapie
 7 Lektionen
7 Lektionen
Arbeit mit Standards in der Pflege
 4 Lektionen
4 Lektionen
MRSA und Pflege
 6 Lektionen
6 Lektionen
Hygiene und Infektionsschutz
 4 Lektionen
4 Lektionen
Die Anwendung von Prophylaxen in der Pflege
 4 Lektionen
4 Lektionen
Weitere theoretische Grundlagen
 12 Lektionen
12 Lektionen
Grundlagen der Arzneimittel
Begriffe
Pharmazie
Wissenschaft von der Zusammensetzung und Herstellung von Arzneimitteln
Pharmakologie
Lehre von den Wechselwirkungen
zwischen Arzneistoffen und dem
Organismus (Arzneistoffe=Pharmaka)
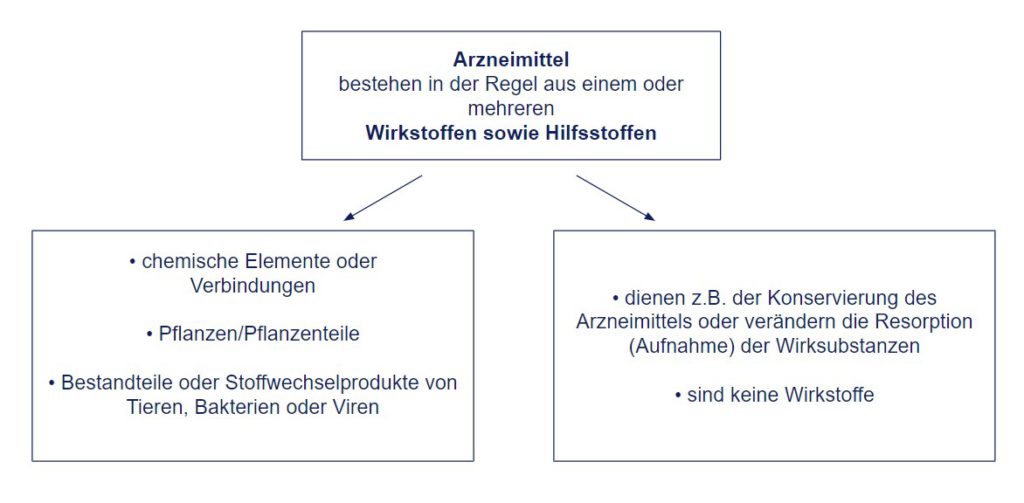
Arzneimittelgesetz (AMG) – § 2 Arzneimittelbegriff:
• „(1) Arzneimittel sind Stoffe und Zubereitungen aus Stoffen, die dazu bestimmt sind, durch Anwendung am oder im menschlichen oder tierischen Körper.
• 1. Krankheiten, Leiden, Körperschäden oder krankhafte Beschwerden zu heilen, zu lindern, zu verhüten oder zu erkennen,
• 2. die Beschaffenheit, den Zustand oder die Funktionen des Körpers oder seelische Zustände erkennen zu lassen,
• 3. vom menschlichen oder tierischen Körper erzeugte Wirkstoffe oder Körperflüssigkeiten zu ersetzen,
• 4. Krankheitserreger, Parasiten oder körperfremde Stoffe abzuwehren, zu beseitigen oder unschädlich zu machen oder
• 5. die Beschaffenheit, den Zustand oder die Funktionen des Körpers oder seelische Zustände zu beeinflussen.“
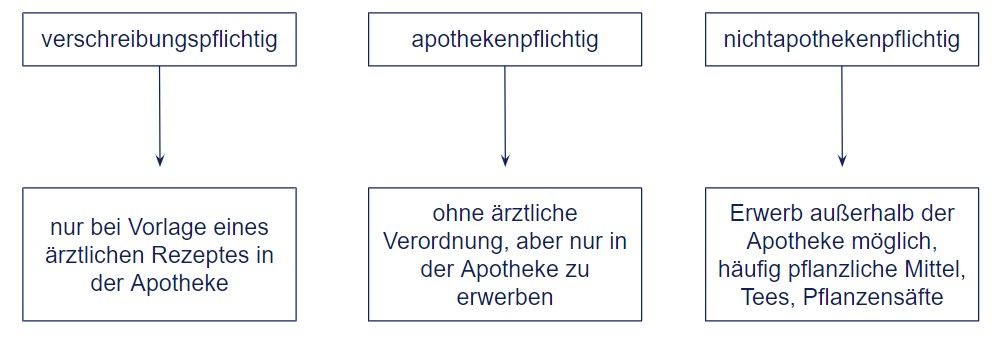
Einteilung der Arzneimittel
Begriffe
Dosis
Resorption
Verteilung
Applikation
Aplikaitonsart
Konzentration, die einen definierten pharmakologischen Effekt erzeugt
Aufnahme einer Substanz in den Körper
nicht sofort gleichmäßig im gesamten Organismus; abhängig von der Durchblutung der einzelnen Gewebe und Organe
Verabreichen des Arzneimittels
Art und Weise der Verabreichung der Arzneimittel
Applikationsarten
• über den oberen Magen-Darm-Trakt (orale Verabreichung in Form von Tabletten, Dragees, Kapseln, Saft oder Tropfen)
• über die Atemwege (inhalativ)
• über die Haut und Schleimhaut (perkutan, z.B. Salben, Cremes, Tinkturen)
• über den Enddarm (rektal, z.B. Zäpfchen)
• durch Einspritzung in die Haut (i.c. = intrakutan)
• durch Einspritzung unter die Haut (s.c. = subkutan)
• durch Einspritzung in den Muskel (i.m. = intramuskulär)
• durch Einspritzung in die Vene (i.v. = intravenös)
• durch Einspritzung in die Arterie (i.a. = intraarteriell)
• durch Einspritzung direkt ins Herz (intrakardial)
Einteilung der Arzneimittel
• Weg der Arznei je nach Form (Tablette, Zäpfchen, Sirup, Injektion, Salbe) in den
Blutkreislauf
• Verteilung über den Blutkreislauf je nach Art seiner Wirkung, Anpassung an die gegebene chemische Umgebung und Eindringen ins Gewebe am Zielort
• nach der Entfaltung seiner Wirkung chemische Umwandlung eines bedeutenden Teiles
in der Leber mit dem Ziel, diese leichter ausscheiden zu können (Metabolismus)
• Ausscheidung
Funktion von Arzneistoffen
• Vorbeugung (z.B. Impfstoffe) von Erkrankungen
• Erkennung (z.B. Kontrastmittel) von Erkrankungen
• Behandlung von Erkrankungen
Kennzeichnung von Arzneimitteln
Arzneimittelgesetz (AMG) – § 10 Kennzeichnung:
• Name und Anschrift des pharmazeutischen Unternehmens
• Bezeichnung des Arzneimittels
• Chargenbezeichnung (Ch.-B., Charge = die in einem Herstellungsgang angefertigte Menge eines Arzneimittels, Chargennummer = Identifikationscode)
• Zulassungsnummer (Zul.-Nr.)
• Inhalt nach Gewicht oder Stückzahl (g, mg, ml, St.)
• Anwendungsweise (oral, parenteral, usw.)
• Wirkstoffe nach Art und Menge
• Darreichungsform (Tbl., Drg., Saft, usw.)
• Lagerhinweis
• Verfallsdatum
• „Verschreibungspflichtig“ (muss vom Arzt verordnet werden)
• „Apothekenpflichtig“ (nur in Apotheken erhältlich)
• „Unverkäufliches Muster“ (nach Anfrage erhalten Ärzte
jährlich 2 Packungen)
• Hinweis – „Für Kinder unzugänglich aufbewahren.“
• „Zur klinischen Prüfung bestimmt“ (noch nicht zugelassen)
Forte | Erhöhte oder starke Dosis |
Minor | Kleinere oder geringere Dosis |
Mite | Schwache oder geringe Stärke |
Retard | Verzögerte und länger anhaltende Wirkung |
Depot | Langzeitwirkung des Medikaments |
Semi | Halbe Dosis |
Sine | Ohne (fehlender Inhaltsstoff) |
Beipackzettel/Packungsbeilage
Herstellerinformationen:
• Beipackzettel in jeder Arzneimittelpackung (gesetzlich vorge-
geben laut AMG)
• Lieferung nützlicher Informationen an den Verbraucher
enthalten Informationen über:
• Zusammensetzung
• Anwendungsgebiete
• Dosierung
• Nebenwirkungen
• Gegenanzeigen
• Wechselwirkungen mit anderen Medikamenten
• Lagerungsbedingungen
• Darreichungsform, Packungsgrößen
• Warnhinweise
Arzneimittelrisiken
durch die Einnahme von Arzneimitteln auftretende Gefahren
Nebenwrkungen
Gegenanzeigen
Abhängigkeiserscheinungen
Wechselwirkungen
Wichtig: Nutzen-Risiko-Abwägung!
Nebenwirkungen
• = sind unerwünschte Wirkungen bei der Einnahme eines Medikamentes,
die zusätzlich zur gewünschten Wirkung auftreten
• reichen von relativ harmlosen Begleiterscheinungen (z.B. Müdigkeit) bis
hin zu Wirkungen, deren Schäden den Nutzeffekt des Medikamentes übersteigen (z.B. Contergan-Missbildungen bei Embryos)
• in der Packungsbeilage aufgelistete Nebenwirkungen müssen nicht auftreten, aus Gründen der Arzneimittelsicherheit muss jedoch auch nur eine einmal aufgetretene Nebenwirkung in der Packungsbeilage angegeben werden
Häufigkeitsangaben
• sehr selten: in weniger als 0,01 % (seltener als bei einem von 10 000 Behandelten)
• selten: in mehr als 0,01 % und in weniger als 0,1 % (bei mehr als einem von 10 000 Behandelten)
• gelegentlich: in mehr als 0,1 % und in weniger als 1 % (bei mehr als einem von 1000 Behandelten)
• häufig: in mehr als 1 % und in weniger als 10 % (bei mehr als einem von 100 Behandelten)
• sehr häufig: in mehr als 10 % (bei mehr als einem von zehn Behandelten)
Allgemeine Nebenwirkungen
• viele Medikamente wirken nicht
nur am gewünschten Ort, sondern
beeinflussen auch andere Organ-funktionen,
z.B. Mundtrockenheit, Herz-
frequenz-, Verdauungs- oder
Hirnfunktionsstörungen,
Schwindel, Müdigkeit, Schlaflosigkeit, Verstopfung, Inkontinenz, Stürze

Allergische Nebenwirkungen

• entstehen durch Sensibilisierung des Organismus,
z.B. Hautausschlag, Schwellungen, Neigung zu Infektionen
• Gefahr eines anaphylaktischen Schocks (schwerwiegende
allergische Reaktion mit Atemnot, Krämpfen, kaltem
Schweiß, schnellem und schwachem Puls)
Arzneimittelinteraktion
Definition
Wechselwirkung zwischen zwei verschiedenen Arzneisubstanzen
Mögliche Folgen
• qualitative und/oder quantitative Veränderungen der Wirkungsweisen gleichzeitig verabreichter Arzneien
• Verstärkung, Abschwächung oder Aufhebung der Wirkung
der Substanzen möglich
• Hinweise zur richtigen Anwendung und optimalen Lagerung beachten!
• Rücksprache/Informationsaustausch mit dem behandelndem Arzt/Ärztin/Apotheke
Gegenanzeigen


 Teile diesen kapitel
Teile diesen kapitel